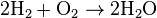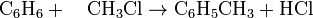Puji dan syukur penulis panjatkan kehadirat Allah SWT, karena atas berkat dan rahmat-Nyalah penulis dapat menyelesaikan makalah ini.
Makalah ini disusun untuk memenuhi salah satu tugas mata kuliah Kimia Dasar II, yang merupakan syarat untuk bisa mengikuti ujian akhir semester genap mata kuliah Kimia Dasar II. Makalah ini membahas tentang Unsur Halogen, sifat-sifatnya, pembuatan dan kegunaannnya dalam kehidupan.
Kepada semua pihak yang telah membantu dalam menyelesaikan pembuatan makalah ini penulis mengucapkan terimakasih, semoga segala bantuannya mendapatkan balasan dari Allah SWT.
Kritik dan saran sangat penulis harapkan demi perbaikan penulisan dimasa yang akan datang. Semoga makalah ini dapat bermanfaat bagi penulis dan pembaca sekalian.
Bandung, Mei 2009
Penulis
Salah satu ciri masyarakat dan Negara yang sedang berkembang adalah dengan adanya kemajuan dibidang pembangunan baik pembangunan materil maupun pembangunan spiritual. Pembangunan spiritual salah satunnya adalah dengan meningkatkan kualitas sumberdaya manusianya.
Peningkatan kualitas sumber daya manusia dapat di lihat dari penggunaan teknologi, kemajuan di bidang industri,dan banyaknya masyarakat yang mengenyam pendidikan. Saat ini ilmu pengetahuan yang sedang berkembang adalah ilmu-ilmu dibidang MIPA. Terutama ilmu kimia.
Di sadari ataupun tidak ilmu kimia memilki peranan yang sangat penting dalam kehidupan kita. Dimulai dari penyusun kromosom, pakaian kita, lingkungan kita, bahkan diri kita merupakan materi kimia.
Salah satu materi kimia yang sering kali di gunakan dalam kehidupan manusia adalah unsur-unsur halogen. baik di bidang industri, pengobatan,dan lain sebagainya. Hal inilah yang mendorong penulis untuk mencoba mengungkapkan mengenai “UNSUR HALOGEN DALAM KEHIDUPAN”.
Adapun tujuan dari penulisan makalah ini adalah sebagai berikut:
a) Memenuhi tugas mata kuliah Kimia Dasar II,
b) Meningkatkan pengetahuan dengan memperdalam pengetahuan mengenai unsur halogen dan penggunaannya,
c) Membantu pembaca dalam membangun kepekaan terhadap penerapan ilmu kimia dalam kehidupan, dan
d) Memperdalam pengetahuan tentang unsur-unsur halogen.
Dalam penulisan makalah ini penulis merasa perlu untuk mengemukakan sistematika penulisan, yaitu sebagai berikut:
BAB I, merupakan pendahuluan yang terdiri dari latar belakng penulisan, tujuan penulisan makalah, dan sistematika penulisan makalah.
BAB II, mereupakan isi atau pembahasan mengenai isi makalah yang membahas tentang halogen, sifat-sifatnya, proses pembuatannya, dan penggunaannya dalam kehidupan.
BAB III, merupakan penutup yang terdiri dari simpulan.
Istilah halogen adalah unsur yang menghasilkan garam, bila bergabung dengan logam. Kata halogen berasal dari tatanama saintifik Perancis pada abad ke-18.
Halogen adalah kelompok
unsur kimia yang berada pada golongan 7 (VII atau VIIA pada sistem lama) di
tabel periodik. Halogen merupakan golongan yang sangat reaktif dalam menerima elektron dan bertindak sebagai elektron kuat.
Halogen tidak menunjukan sifat logam. Jumlah electron pada kulit terluarnya adalah 7 elektron, mampu menerima sebuah electron dalam membentuk ion Halida, atau membentuk pasangan elektron dengan atom lain membentuk ikatan kovalen tunggal.
Unsur-unsur halogen secara alamiah berbentuk
molekul diatomik. Mereka membutuhkan satu tambahan
elektron untuk mengisi
orbit elektron terluarnya, sehingga cenderung membentuk
ion negatif bermuatan satu. Ion negatif ini disebut ion halida, dan garam yang terbentuk oleh ion ini disebut
halida.
Halogen merupakan golongan non-logam yang sangat reaktif, sehingga unsur-unsurnya tidak dijumpai pada keadaan bebas. Pada umumnya ditemukan dialam dalam bentuk senyawa garam-garamnya. Garam yang terbentuk disebut Halida. Flourin ditemukan dalam mineral-mineral pada kulit bumi: fluorspar (CaF2) dan kriolit (Na3AlF6). Klorin, Bromin, dan Iodin terkandung pada air laut dalam bentuk garam-garam halida dari natrium, magnesium, kalium, dan kalsium. Garam halida yang paling banyak adalah NaCl 2,8% berat air laut. Banyaknya ion halida pada air laut : 0,53 M Cl- ; 8X10-4 M Br- ; 5X10-7 M I-. Selain itu, klorin ditemukan di alam sebagai gas Cl2, senyawa dan mineral seperti kamalit dan silvit.
Iodin ditemukan dalam jumlah berlimpah sebagai garan (NaIO3) di daerah Chili, Amerika Serikat. Iodin yang ditemukan dalam senyawa NaI banyak terdapat pada sumber air diwatudakon ( Mojokerto).
Selain di alam, ion halida juga terdapat dalam tubuh manusia. Ion clorida merupakan anion yang terkandung dalam plasma darah, cairan tubuh, air susu, air mata, air ludah, dan cairan ekskresi. Ion iodida terdapat dalam kelenjar tiroid. Ion flourida merupakan komponen pembuat bahan perekat flouroaptit [Ca5(PO4)3F] yang terdapat pada lapisan email gigi.
Unsur-unsur ini tidak ditemukan di alam dalam keadaan bebas, melainkan dalam bentuk garamnya. Oleh karena itu unsur-unsur nonlogam ini dinamakan HALOGEN, yang berasal dari kata halos=garam genes=pembentuk jadi artinya pembentuk garam. Unsur nonlogam yang termasuk ke dalam golongan Halogen yaitu Fluor (F2), Klor (Cl2), Brom (Br2), Iodium (I2), dan Astatin (At2).
1. Fluor
Ditemukan dalam fluorspar oleh Schwandhard pada tahun 1670 dan baru pada tahun 1886 Maisson berhasil mengisolasinya. Merupakan unsur paling elektronegatif dan paling reaktif. Dalam bentuk gas merupakan molekul diatom (F2), berbau pedas, berwarna kuning mudan dan bersifat sangat korosif. Serbuk logam, glass, keramik, bahkan air terbakar dalam fluorin dengan nyala terang. Adanya komponen fluorin dalam air minum melebihi 2 ppm dapat menimbulkan lapisan kehitaman pada gigi.
2. Klor
Ditemukan oleh Scheele pada tahu 1774 dan dinamai oleh Davy pada tahun 1810. Klor ditemukan di alam dalam keadaan kombinasi sebagai gas Cl2, senyawa dan mineral seperti kamalit dan silvit. Gas klor berwarna kuning kehijauan, dapat larut dalam air, mudah bereaksi dengan unsur lain. Klor dapat mengganggu pernafasan, merusak selaput lender dan dalam wujud cahaya dapat membakar kulit.
3. Brom
Ditemukan oleh Balard pada tahun 1826. merupakan zat cair berwarna coklat kemerahan, agak mudah menguap pada temperatur kamar, uapnya berwarna merah, berbau tidak enak dan dapat menimbulkan efek iritasi pada mata dan kerongkongan. Bromin mudah larut dalam air dan CS2 membentuk larutan berwarna merah, bersifat kurang aktif dibandingkan dengan klor tetapi lebih reaktif dari iodium.
4. Iodium
Ditemukan oleh Courtois pada tahun 1811. Merupakan unsur nonlogam. Padatan mengkilap berwarna hitam kebiruan. Dapat menguap pada temperatur biasa membentuk gas berwarna ungu-biru berbau tidak enak (perih). Di alam ditemukan dalam air laut (air asin) garam chili, dll. Unsur halogen ini larut baik dalam CHCl3, CCl4, dan CS2 tetapi sedikit sekali larut dalam air. Dikenal ada 23 isotop dan hanya satu yang stabil yaitu 127I yang ditemukan di alam. Kristal iodin dapat melukai kulit, sedangkan uapnya dapat melukai mata dan selaput lendir.
5. Astatin
Merupakan unsur radioaktif pertama yang dibuat sebagai hasil pemboman Bismuth dengan partikel-partikel alfa (hasil sintesa tahun 1940) oleh DR. Corson, K.R. Mackenzie dan E. Segre. Dikenal ada 20 isotop dari astatin, dan isotop At(210) mempunyai waktu paruh 8,3 jam (terpanjang). Astatin lebih logam disbanding iodium. Sifat kimianya mirip iodium, dapat membentuk senyawa antar halogen (AtI, AtBr, AtCl), tetapi belum bisa diketahui apakah At dapat membentuk molekul diatom seperti unsur halogen lainnya. Senyawa yang berhasil dideteksi adalah HAt dan CH3At.
Sifat fisika dan kimia halogen
| X2 | Fluor (F2) | Klor (Cl2) | Brom (Br2) | Iodium (I2) |
| 1. Molekulnya | Diatom |
| 2. Wujud zat (suhu kamar) | Gas | Gas | Cair | Padat |
| 3. Warna gas/uap | Kuning muda | Kuning hijau | Coklat merah | Ungu |
| 4. Pelarutnya (organik) | CCl4, CS2 |
| 5. Warna larutan (terhadap pelarut 4) | Tak berwarna | Tak berwarna | Coklat | Ungu |
| 6. Kelarutan oksidator | (makin besar sesuai dengan arah panah) |
| 7. Kereaktifan terhadap gas H2 |
| 8. Reaksi pengusiran pada senyawa halogenida |   X = Cl, Br, I
F 2 + 2KX 2KF X 2 | X = Br dan I
Cl2 + 2KX 2KCl + X2 |  X = I
Br 2 + KX 2KBr + X 2 | Tidak dapat mengusir F, Cl, Br |
| 9. Reaksi dengan logam (M) |  2 M + nX 2 2MXn (n = valensi logam tertinggi) |
| 10. Dengan basa kuat MOH (dingin) |  X 2 + 2MOH MX + MXO + H 2O (auto redoks) |
| 11. Dengan basa kuat (panas) |  3X 2 + 6MOH 5MX + MXO 3 + 3H 2O (auto redoks) |
| 12. Pembentukan asam oksi | Membentuk asam oksi kecuali F |
|  Catatan : Catatan :
I 2 larut dalam KI membentuk garam poli iodida
I 2+K Kl 3
I 2 larut terhadap alkohol coklat |
v Sifat Fizik
Sifat-sifat fizik halogen berubah secara beransur-ansur apabila menuruni kumpulan. Beberapa sifat fizik halogen ialah seperti:
§ Semua halogen adalah bukan logam.
§ Semua halogen wujud sebagai molekul dwiatom pada suhu bilik.
§ Warna elemen-elemen kumpulan VII semakin gelap apabila menuruni kumpulan.
§ F = gas kuning pucat
§ Cl= gas kuning kehijauan
§ Br= cair merah gelap (dengan asap merah)
§ I = pejal kelabu kehitaman (menjalani pemejalapan kepada asap ungu)
§ ukuran atom (jari-jari atom) halogen semakin bertambah.
§ Sangat reaktif dan senang menjadi garam. Kereaktifan berkurang menuruni kumpulan.
§ Semua halogen mempunyai kekuatan yang rendah. Walau bagaimanapun, kekuatan halogen semakin bertambah apabila semakin menurun dalam system periodik unsur.
§ Semua halogen mempunyai titik lebur dan titik didih yang rendah kerana molekul-molekul halogen ditarik bersama oleh daya Van der Waals yang lemah dan hanya sedikit tenaga diperlukan untuk mengatasinya. Semakin ke bawah, titik lebur dan titik didih halogen meningkat.
§ Kekuatan pengoksidaan halogen berkurang menuruni kumpulan.
§ Semua halogen tidak boleh mengalirkan listrik.
| Unsur | F | Cl | Br | I |
| Jari-iari atom (nm) | 0.071 | 0.099 | 0.144 | 0.133 |
| Jari-jari ion (nm) | 0.133 | 0.180 | 0.195 | 0.215 |
| Keelektronegatifan | 4.0 | 3.0 | 2.8 | 2.5 |
| Titik lebur (oC) | -220 | -220 | -7 | 114 |
| Titik didih (oC) | -188 | -35 | 59 | 184 |
| No atom | 9 | 17 | 35 | 53 |
| Konfigurasi elektron | [He]2S22P5 | [Ne]3S23P5 | [Ar]4S24P5 | [Kr]5S25P5 |
| Potensial pengion | 17,42 | 18,01 | 11,84 | 11,84 |
| Potensial reduksi | +2,87 | +2,86 | +1,09 | +0,54 |
| bilok | -1;0 | -1;0;1;3;5;7 | -1;0;1;5 | -1;0;1;5 |
| Afinitas elektron | 19,5 | 83,4 | 77,3 | 70,5 |
| Massa atom relatif | 18,9984 | 35,453 | 79,904 | 126,9045 |
| Kerapatan cairan(gcm-3) | 1,1 | 1,5 | 3,2 | 4,9 |
| Entalpi penguapan(kjmol-1) | 3,3 | 10 | 15 | 21 |
| Energi ionisasi | 1686 | 1266 | 1146 | 1016 |
| Keelektronegatifan | 4 | 3 | 2,8 | 2,5 |
| Jari-jari kovalen/pm | 72 | 99 | 114 | 133 |
| Entalpi hidrasi X-(kjmol-1) | 401 | 279 | 243 | 201 |
| Daya hantar molarion X- | 44,4 | 76,4 | 78,3 | 76,8 |
| Kalor disosiasi(kj/mol) | 158 | 242 | 193 | 151 |
v Sifat Kimia
Dalam membincangkan sifat kimiahalogen, kadangkala fluorin dan astatin diabaikan. Hal ini demikian kerana semua isotop astatin adalah bahan radioaktif. Fluorin juga mempunyai sifat-sifat anomali karena ukurannya yang kecil dan keelektronegatifannya yang tinggi.
Beberapa oksida halogen:
· Oksida dari fluor: O2F2, OF2
· Oksida dari klor : Cl2O2, ClO2, Cl2O6, Cl2O7
· Oksida dari brom : Br2O, BrO2. BrO3
· Oksida dari yod : I2O4, I4O8, I2O5
Kecuali yod (V) oksida semua senyawa diatas tidak stabil jika dipanaskan. I2O5 hanya dapat terurai diatas suhu 300Oc.
v Monooksida OF2, Cl2O, dan Br2O.
v Dioksida , ClO2, BrO2, dan I2O4.
Auto oksidasi reduksi atau disdroporsionasi adalah senyawa halogen yang reaksinya berkawanan dilingkungan asam dan basa. Iod stabil dilingkungan asam akan tetapi dapat berubah menjadi iodat dalam suasana basa.

6I
2 +12OH
- 2IO
3- + 10I
- + 6H
2O
Pada reaksi ini iod (I2) dengan bilok= 0 teroksidasi menjadi iodat dengan bilok +5 dan tereduksi menjadi iodida (I-) dengan bilok = -1.
Semua halogen larut dalam air dan membentuk asam halida dan asam hipohalida. Fluor bereaksi sempurna dengan air. Berbeda dari Cl2, Br2, dan I2, fluor sangat cepat bereaksi dengan air menghasilkan O2 dan HF.

Air khlor: Cl2 + H
2O
HCL + HClO

Air Brom: Br
2 +H
2O
HBr + HBrO
Garam halida larut dalam air kecuali Ag+, Pb+, dan Hg2+.

Bila diteteskan NH
4OH, AgCl akan larut , AgBr sedikit larut, tetapi AgI tidak larut. Air khlor juga dapat dipakai menunjukan halogen.

Air khlor + Cl
-

Air khlor + Br
- Br
2 merah coklat, sedikit ;arut dalam

Cs
2 coklat


Air khlor + I
- I
2 merah coklat. Larut dalam

Cs
2 ungu

Atau dengan kanji
biru
Brom dan iod dapat larut dalam pelarut non polar, seperti alcohol CCl4, CHCl3, dan CS2. salah satu sifat HF yang paling penting adalah HF dalam benruk ga atau larutan akan bereaksi dengan SiO2 sehingga dalam penyimpanannya harus disimpan dalam plastic teflan dan tidak dalam kaca.

4 HF +SiO
3 SiF
4 + 2H
2O
Karena itu HF dipakai untuk mengetsa kaca.
| No | UNSUR | HF | HCl | HBr | HI |
| 1 | Wujud zat | Gas Air |
| 2 | Pelarut |
| 3 | Sifat reduktor |  Makin kuat  Makin kuat |
| 4 | Keasaman |
Halogen dapat membentuk empat macam senyawa antar halogen. XX1, XX13, XX15, XX17. senyawa ini dapat dibuat dengan mereaksikan langsung unsur-unsur tersebut dalam tabung nikel.contoh senyawa anatar halogen:
· CIF gas tidak berwarna,
· CIF3 gas tidak berwarna,
· CIF5 gas tidak berwarna,
· BrF gas berwarna merah,
· BrF3 cairan tidak berwarna,
· BrF5 cairan tidak berwarna.
· BrCl gas berwarna merah,
· IF3 padatan berwarna kuning,
· IF5 cairan tidak berwarna,
· ICl cairan berwarna tua, kristal hiotam,
· ICl3 padatan kuning,
· IBr padatan coklat-hitam.
Hubungan periodic antar halogen dapat dilihat pada table berikut.
| Energi ionisasi (EI) (kj/mol)  X(g) X +(g)+ e | F(1686)>Cl(1262)> Br(1146)>I(1016) |
| Potensial elektroda (V)  X 2(aq)+2e 2X -(aq) | F2(+2,87)> Cl2(+1,36)> Br2(+1,07)> I(+0,54) |
| Kereaktifan terhadap unsur lain | F2> Cl2> Br2> I2 |
| Kebebasan X- | F-> Cl-> Br-> I- |
| Keelektronegatifan | F(4)>Cl(3)> Br(2,8)> I(2,5) |
Asam oksi adalah halogen yang mengandung oksigen. Hamya fluor yang tidak bias membentuk asam oksi. Misalnya HClO, HClO2,HClO3, HClO4. Makin banyak atom oksigen yang terikat pada atom Cl, makin lemah ikatan H-O makin kuat asam tersebut. HClO< HClO2< HClO3< HClO4
Ion Cl mempunyai bilok yang cukup banyak (hal ini di sebabkan oleh afinitas elektron dari atom Cl yang sangat tinggi.
Senyawa fluoride banyak digunakan dalam industri. Fluorospar, CaF2 digunakan dalam jumlah yang besar diindustri baja. Sebagai fluks fluoride dapat berfungsi dengan baik sehingga oksida leburan lebih efisiensi dan dapat memecah terak polimer yang kental. Fluoride seperti CaF2 dapat menimbulkan polusi. Polusi udara dari partikrl fliorida biasanya berasal dari industri alumunium, bata, genteng dan bubuk fosfat.
Jika terus menerus untuk waktu yang lama seseorang menyentuh ion F-di atas 6 ppm, dapat menderita keracunan fluorosis yang merusak tulang dan gigi. Di beberapa Negara ion F- di tambah kedalam air PAM sehingga ion F- mencapai 1 ppm. Fluorida yang digunakan adalahNaF, HF, CaF2 (dengan Al3+). Untuk meningkatkan kualitas email gigi pasta gigi di tambah SnF2, atau NaF. Email gigi mengandung hidroksi apatit 3 Ca3(PO4)2.Ca(OH)2 dan sebagian melindungi karbonat. Sisa makanan yang membusuk dapat menghasilkan asam yang dapat merusak OH- dari apatit. Dengan adanya ion F- pada gigi ank-anak terbentuk fluorapatit yang tahan asam dan kuat. Daun the dapat mengandung ion F- , sampai 100 ppm, dan satu cangkir teh dapat mangandung 1 ppm F-.
Dalam ikatan pengoksidaan, halogen bertukar dari X2 kepada X-(aq). Oleh kerana kekuatan pengoksidaan berkurangsemakin kebawah, satu halogen bisa memberikan halogen yang berada dibawahnya. Sebagai contoh, apabila Cl2 ditambah dalam larutan kalium bromida, KBr, dan kalium iodida, KI, berikatan yang berlaku adalah seperti berikut:
· Cl2(aq) + 2Br-(aq) → 2Cl-(aq) + Br2(aq)
· Cl2(aq) + 2I-(aq) → 2Cl-(aq) + I2(aq)
terdapat satu masalah - larutan halida tidak berwarna (larutan halogen yang cair juga kadang-kadang tidak berwarna). Untuk memudahkan pemerhatian dijalankan, biasanya sikloheksana ditambahkan. Halogen larut dengan lebih mudah dalam pelarut organik berbanding dalam bentuk akueus. dalam sikloheksana, bromin berwarna jingga terang manakala iodin ungu.
Sebagai contoh, apabila air bromin dilarutkan dalam sikloheksana, warna jingga terang dapat dilihat. Apabila KI ditambahkan, warna jingga terang bertukar kepada ungu, tanda bahawa tindak balas penyesaran berlaku.
Halogen berikatan dengan hidrogen untuk membentuk hidrogen halida.
H2 + X2 → 2HX (X mewakili satu-satu halogen)
Kereaktifan ikatan berkurang apabila semakin menurun kerana ukuran atom yang semakin besar. Hidrogen klorida meletup jika terkena sinaran ultraviolet tetapi H dan Br hanya akan berikatan dengan perlahan . Iodin juga akan berikatan dengan H jika diberikan energi, namun ikatan ini tidak lengkap.
Corak kereaktifan ini dapat diterangkan dengan dua cara. Pertama, melalui ukuran atom halogen. Oleh kerana semua halogen berikatan dengan hidrogen, maka ukuran hidrogen adalah tetap. Semakin kebawah, ukuran atom semakin besar dengan pertambahan petala. Hal ini menyusahkan inti hidrogen berinteraksi dengan inti halogen untuk membentuk ikatan kovalen.
Berlangsungnya suatu reaksi tidak hanya ditentukan oleh potensial sel. Tetapi, berlangsung tidaknya suatu reaksi dapat dilihat dari reaksi pendesakkan halogen. Halogen yang terletak lebih atas dalam golongan VII A dalam keadaan diatomik mampu mendesak ion halogen dari garamnya yang terletak dibawahnya.
Contoh: F2 + 2KCl → 2KF + Cl2
Br- + Cl2 → Br2 + Cl‑
Br2 + 2I- → Br- + I2
Br2 + Cl- → (tidak bereaksi)
I2 + Br- → (tidak bereaksi)
Data potensial reduksi:
F2 + 2e- → 2F- Eo= +2,87 Volt
Cl2 + 2e- → 2Cl- Eo= +1,36 Volt
Br2 + 2e- → 2Br- Eo= +1,06 Volt
I2 + 2e- → 2I- Eo= +0,54 Volt
Potensial reduksi F2 paling besar sehingga akn mudah mengalami reduksi dan disebut oksidator terkuat. Sedangkan terlemah adalah I2 karena memiliki potensial reduksi terkecil.
Sifat oksidator: F2 > Cl2 > Br2 > I2
Sifat reduktor : I- > Br- > Cl- > F-
Reduktor terkuat akan mudah mengalami oksidasi mudah melepas elektron ion iodida paling mudah melepas electron sehingga bertindak sebagai reduktor kuat.
Sifat asam yang dapat dibentuk dari unsur halogen, yaitu: asam halida, dan oksilhalida.
a. Asam halida (HX)
Asam halida terdiri dari asam fluorida (HF), asam klorida (HCl), asam bromida (HBr), dan asam iodida (HI). Kekuatan asam halida bergantung pada kekuatan ikatan antara HX atau kemudahan senyawa halida untuk memutuskan ikatan antara HX.
Dalam golongan VII A, semakin keatas ikatan antara atom HX semakin kuat. Urutan kekuatan asam :
HF < HCl < HBr < HI
b. Titik didih asam halida
Titik didih dipengaruhi oleh massa atom relative (Mr) dan ikatan antar molekul :
Semakin besar Mr maka titik didih semakin tinggi.
Semakin kuat ikatan antarmolekul maka titik didih semakin tinggi.
Pengurutan titik didih asam halida:
HF > Hi > HBr > HCl
Pada senyawa HF, walaupun memiliki Mr terkecil tetapi memiliki ikatan antar molekul yang sangat kuat “ikatan hydrogen” sehingga titik didihnya paling tinggi.
Halogen bereaksi dengan sebagian besar logam menghasilkan senyawa garam/halida logam.
2Na + Cl2 → NaCl
2Fe + 3Cl2 → 2FeCl3
Sn + 2Cl2 → SnCl4
Mg + Cl2 → MgCl2
2Al + 3Cl2 → 2AlCl3
Halida logam yang terbentuk bersifat ionic jika energi ionisasina rendah dan logamnya memiliki biloks rendah. Hamper semua halide bersifat ionik. Contoh Na+, Mg2+, Al3+. Sedangkan yang bersifat semi ionok adalah AlCl3.
Halogen bereaksi dengan non-logam membentuk asam halida/senyawa halide. Halogen dapat bereaksi dengan oksigen,fosfor, dan beberapa unsur lain. Contoh :
Xe + F2 → XeF2
2Kr + 2F2 → KrF4
2P + 3Cl2 → 2PCl3
2B +3Cl2 → 2BCl3
2Si + 2Cl2 → SiCl4
Reaksi halogen dengan basa enser dingin menghasilkan halida ( X- ) dan hipohalida ( XO- ), sedangkan reaksi halogen dengan basa pekat panas menghasilkan halida ( X- ) dan halat ( XO3- ). Contoh :
X2 + 2NaOH ( encer, dingin ) → NaX +NaXO + H2O ( X = Cl, Br, I )
X2 + 2NaOH ( pekat, dingin ) → NaX +NaXO + H2O ( X = Cl, Br, I )
2F2 + 2NaOH ( encer, dingin ) → 2NaF + OF2 + H2O
2F2 + 2NaOH ( pekat, panas ) → NaX + O2 + H2O
- Pembuatan Halogen dalam Industri
Elektrolisis KHF2, dalam HF bebas air.
Fluor yang terbentuk dikompres kedalam tabung baja.
Flourin diperoleh melalui proses elektrolisis garam kalium hydrogen flourida (KHF2) dilarutkan dalam HF cair, ditambahkan LiF 3% untuk menurunkan suhu sampai 100oC. Elektrolisis dilaksanakan dalam wajah baj dengan katode baja dan anode karbon. Campuran tersebut tidak boleh mengandung air karena F2yang terbentukakan menoksidasinya.
KHF2 → K+ + HF2-
HF2 → H+ + 2F-
Katode : 2H+ + 2e- → H2
Anode : 2F- → F2 + 2e-
Untuk mencegah kontak (reaksi) antara logam Na dan gas Cl2 yang terbentuk digunakan diafragma berupa monel ( sejenis campuran logam ).
a. Sel down : elektrolisi leburan natrium klorida
Proses downs yaitu elektrolisis leburan NaCl (NaCl cair). Sebelum dicairkan, NaCl dicampurkan dahulu dengan sedikit NaF agar titik lebur turun dari 800oC menjadi 600oC.
Katode : Na+ 2e- → Na
Anode : 2Cl- → Cl2 + 2e-
Untuk mencegah kontak (reaksi) antara logam Na dan Cl2 yang tebentuk, digunakan diafragma lapisdan besi tipis.
b. Sel Castner-Kellner atau sel Billitar, elektrolisis larutan pekat NaCl.
c. Proses gibbs, yaitu elektrolisis larutan NaCl.
Katode : 2H2O + 2e- → 2OH- + H2
Anode : 2Cl- → Cl2 + 2e-
d. Modifilasi proses Deacon
Oksidasi gas HCl yang mengandung udara dengan menggunakan katalis tembaga.

4 HCl + O
2 2 Cl
2 + 2 H
2O
Berlangsung pada suhu ± 430oC dan tekanan 200 atm. Hasil reaksinya teercampur ± 44% N2.
a) Dalam ekstra KCl dan MgCl2 dari carnalite terdapat MgBr2 0,2%

MgBr
2 + Cl
2 MgCl
2 + Br
2b) Air laut disamakan dengan H2SO4 encer dan direaksikan dengan klor, penambahan asam dilakukan agar tidak terjadi hidrolisis. Dengan penghembusan udara diperoleh volume yang cukup besar yang mengandung brom kemudian dicampur dengan SO2 dan uap air.

SO
2 + Br
2 + H
2O
2 HBr + H2S04
Kemudian direaksikan dengan Cl2

2 HBr + Cl
2 2 HCl + Br
2Penyulingan dengan KBr dapat menghilangkan klor dan dengan penambahan KOH dapat menghilangkan I2.

Cl
2 + 2 KBr
2 KCl + Br
2
I
2 + OH
- I
- + OI
- + H
2O
a) Garam chili mengandung NaIO3 0,2 %
Setelah mengkristalkan NaNO3, filtrat yang mengandung IO-3 di tambah NaHSO3 lalu di asamkan.

IO
-3 +3 HSO
-3 I
- + 3 HSO
-4
5 I
- + IO
-3 + 6 H
+ 3 I
2 + 3 H
2O
b) Dari ganggang laut.
c) 2NaIO3 + 5NaHSO3 → 3NaHSO4 + 2Na2SO4 + H2O + I2 Atau :2IO3- + 5HSO3- → 5SO42- + 3H+ + H2O +I2
Endapan I2 yang terbentuk disaring dan dimurnikan dengan cara sublimasi.
- Pembuatan HaLogen di Laboratorium
Di laboratorium, zat-zat kimia dibuat dalam jumlah seperlunya untuk digunakan eksperimen/praktikum dengan cara yang cepat dan alat yang sederhana. Klorin, bromin, dan iodine dapat dihasilkan dari oksidasi terhadap senyawa halida dengan oksidator MnO2 atau KMnO2 dalam lingkungan asam. Senyawa halide dicampurkan dengan MnO2 atau KMnO2 ditambahkan H2SO4 pekat, kemudian dipanaskan. Reaksi yang berlangsung secara umum :
2X- + MnO2 + 4H+ → X2 + Mn2+ + 2H2O
10X- + 2MnO4- + 16H+ → 5X2 + 2Mn2+ + 8H2O
Senyawa klorin juga dapat dibuat dalam skala labooratorium dengan cara :
o Proses Weldon
Dengan memanaskan campuran MnO2, H2SO4, dan NaCl
Reaksi : MnO2 + 2H2SO4 + 2 NaCl → Na2SO4 + MnSO4 + H2O + Cl2
o Mereaksikan CaOCl2 dan H2SO4
CaOCl2 + H2SO4 → CaSO4 + H2O + Cl2
o Mereaksikan KMnO4 dan HCl
KMnO4 + HCl → 2KCl + MnCl2 + 8H2O + 5Cl2
Sifat oksidator bromin yang tidak terlalu kuat. Dalam proses industri, bromine dibuat dengan cara mengalirkan gas klorin ke dalam larutan bromide.
Reaksi : Cl2 + 2Br- → Br2 +2Cl-
Dalam skala laboratorium, bromin dibuat dengan cara :
o Mencampurkan CaOCl2, H2SO4, dengan bromida.
CaOCl2 + H2SO4 → CaSO4 + H2O + Cl2
Cl2 + 2Br- → Br2 + 2Cl-
o Mencampurkan KMnO4 dan HBr pekat.
o Mencampurkan bromide, H2SO4, dan MnO2.
Unsur iodine dapat dibuat dengan cara.
o Dengan mereaksikan NaIO3 dan natrium bisilfit.
2NaIO3 + 5N4H2SO3 → 3NaHSO4 + 2Na2SO4 + H2O + I2
o Dalam skala laboratorium pembuatan iodin analog dengan pembuatan bromin, hanya saja bromida diganti dengan iodida.
Senyawa HF dan HCl dapat dibuat juga di laboratorium dengan mereaksikan garam halide (NaF dan CaCl2) dengan asam sulfat pekat dan dipanaskan sesuai dengan persamaan reaksiberikut :
2NaF + H2SO4 → Na2SO4 + 2HF
CaCl2 + H2SO4 → CaSO4 +2HCl
Senyawa HI dan HBr tidak dapat dibuat seperti itu karena Br- atau I- akan dioksidasi oleh H2SO4.
2NaBr + H2SO4 → Na2SO3 + Br2 + H2O
MgI2 + H2SO4 → MgSO3 + I2 + H2O
HBr dan HI biasanya dibuat dengan pereaksi H3PO4.
3NaBr +H3PO4 → Na3PO4 + 3HBr
3MgI2 + 2H3PO4 → Mg3(PO4)2 + 6HI
Cl2, Br2 dan I2 dapat di buat dengan mereaksikan suatu halide alkali dengan asam sulfat encer dan MnO2.

MnO
2 + 4 H
+ + 2X
- Mn
2+ + 2 H
2O + X
2Klor dapat di buat juga dengan reaksi

2 MnO
-4 +
10 Cl
- + 16 H
+ 2 Mn
2+ + 8 H
2O + Cl
2Brom dan yod dapat di buat dengan cara oksidasi bromide dan yodida dengan gas klor.

Cl
2 + 2 Br
- 2 Cl
- + Br
2
Cl
2 + 2 I
- 2 Cl
- + I
2
Ø Penggunaan fluor
1. pembuatan UF6 agar dapat memisahkan 235U dan 238U dengan cara difusi atau sentrifuga.
2. pembuatan Teflon (-CF2-CF-)n , freon (CCl2F2), dan insektisida (CCl3F)
3. pembuatan sulfur heksafluorida
4. Asam flourida digunakan untuk mengukir (mengetsa) gelas.
Reaksi : CaSiO3 + 8HF → H2SiF6 + CaF2 + 3H2O
5. Natrium heksafluoroksilikat ( Na2SiF6 ) digunakan untuk bahan campuran pasta gigi.
6. Natrium fluorida ( NaF ) untuk mengawetkan kayu.
7. Belerang hexafluorida ( SF6 ) sebagai insulator.
8. Kriolit ( Na3AlF6 ) sebagai bahan pelarut dalam pengolahan bahan alumunium.
9. Freon-12 ( CF2Cl2 ) sebagai zat pendingin pada kulkas dan AC.
10. Teflon digunakan sebagai pada peralatan mesin.
Ø Penggunaan klor
1. pembuatan plastic (PVC)
2. pembuatan pelarut untuk cat, untuk membersihkan logan dari lemak, dry cleaning,
3. pembuatan unsur (Mg, Ti, Br2)
4. pembuatan senyawa organic, insektisida
5. klor dalam jumlah yang banyak digunakan dalam industri pengelantang
· Ca(OCl2).CaCl2.Ca(OH)2.H2O
· NaOCl
· Cl2 cair.
6. klorinasi kaleng bekas untuk mendapatkan kembali (recovery) timah.
7. pembuatan klorat (V) dan klorat (VII) di pakai sebagai bahan peledak dan bahan bajar roket.
8. Asam klorida ( HCl ) digunakan pada industri logam. Untuk mengekstrasi logam tersebut.
9. Natrium klorida ( NaCl ) digunakan sebagai garam dapur.
10. Kalium klorida ( KCl ) sebagai pupuk tanaman.
11. Amoniumklorida ( NH4Cl ) sebagai bahan pengisi batu baterai.
12. Natrium hipoklorit ( NaClO ) digunakan sebagai pengelontang ( breaching agent ) untuk kain dan kertas.
ClO‑ + zat pewarna → Cl- + zat tak berwarna
13. CaOCl2/( Ca2+ )( Cl- )( ClO- ) sebagai serbuk pengelontang atau kapur klor.
14. Kalsium hipoklorit ([Ca( OCl2 )2 ] sebagai zat disenfekton pada air ledeng.
15. Kalium klorat (KCl) bahan pembuat mercon dan korek api.
16. Seng klorida (ZnCl2) sebagai bahan pematri (solder).
Ø Penggunaan brom
1. pembuatan 1-2 dibromometna untuk ditambah kedalam bensin
2. pembuatab senyawa organik
3. obat-obatan
4. Natrium bromide (NaBr)sebagai obat penenang saraf
5. Perak bromide(AgBr)disuspensikan dalam gelatin untuk film fotografi
6. Metil bromide(CH3Br)zat pemadam kebakaran
7. Etilen dibromida(C2H4Br2)ditambahkan pada bensin untuk mengubah Pb menjadi PbBr2
Ø Pnggunaan yod
1. obat-obatan
2. pembuatan zat warna
3. Quartz-Yod untuk bola lampu, NH4I untuk lensa Polaroid, AgI intuk fotografi.
4. mengidentifikasi amilum
5. Kalium Iodat(KIO3)ditambahkan pada garam dapur.
6. odoform(CHI3)merupakan zat organic
7. Perak Iodida(AgI)digunakan dalam film fotografi.
Istilah halogen adalah unsur yang menghasilkan garam, bila bergabung dengan logam. Kata halogen berasal dari tatanama saintifik Perancis pada abad ke-18.
Semua halogen wujud sebagai molekul-molekul dwiatom. Halogen lebih elektronegatif kerana mempunyai 7 elektrovalens - dua dalam subpetala s dan lima dalam subpetala p. Oleh kerana satu sahaja lagi elektron diperlukan untuk mencapai susunan oktet, maka halogen cenderung untuk menerima elektron dari unsur lain untuk memenuhkan petala elektron luarnya. Ini akan menghasilkan ion bertanda negatif satu, dan dipanggil ion halida; garam yang mengandungi ion ini dipanggil halida. Namun, klorin mampu menunjukkan nomor pengoksidaan dari -1 sehingga +7. Halogen boleh membentuk ikatan kovalen maupun ionik untuk mencapai susunan oktet.
Ion halida juga bias bereaksi dengan atom hidrogen/air untuk menghasilkan asid. Contoh reaksinya ialah klorin bereaksi dengan air menghasilkan asid hidroklorik dan asid hipoklorus (agen peluntur).
Unsur-unsur halogen mempunyai konfigurasi ns2 np5. unsure halogen merupakan unsure yang paling reaktif diantara unsure non logam. Titik leleh dan titik didih pada halogen bertambah jika no atom bertambah., halogen mempunyai sifat-sifat fisika dan sifat kimia.
 products, as shown in the following example,
products, as shown in the following example,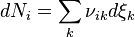 .
. .
.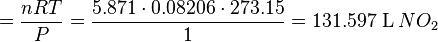
 and
and